




Ouderen met acute myeloïde leukemie hebben een andere onderliggende biologie dan jongere patiënten. Dr. Jurjen Versluis (internist-hematoloog, Erasmus MC, Rotterdam) en collega’s ontwikkelden een nieuwe risicoclassificatie speciaal voor patiënten ouder dan 60 jaar op basis van een grote dataset, die beter onderscheid kan maken tussen verschillende prognostische groepen dan de huidige classificatie. Dit kan waardevolle informatie geven bij behandelkeuzes.
Ongeveer twee derde van de patiënten met acute myeloïde leukemie (AML) is ouder dan 60 jaar, en hun uitkomsten zijn over het algemeen slechter dan die van jongere patiënten. Intensieve chemotherapie, vaak gevolgd door allogene hematopoëtische celtransplantatie (allo-HCT), vormt de belangrijkste, potentieel curatieve behandeling voor fitte, oudere patiënten. Een risicoclassificatie kan helpen om te bepalen welke oudere patiënten het meest gebaat zijn bij intensieve chemotherapie, en welke intensief behandelde oudere patiënten het meest profiteren van allo-HCT als consolidatietherapie.
Voor AML bestaat al een risicoclassificatie van het European LeukemiaNet (ELN), met een laatste update van 2022. “De ELN 2022-classificatie is gebaseerd op gegevens van jongere AML-patiënten”, vertelt Jurjen Versluis. “Maar er zijn weinig modellen gemaakt voor oudere patiënten, en we denken dat dit echt andere patiënten zijn dan jongere AML-patiënten. Dat zien we ook: bij oudere patiënten komen meer mutaties en meer cytogenetische afwijkingen voor. Volgens de ELN 2022-classificatie valt bijna 60% van de oudere patiënten in de adverse risk-categorie, en dat voelt onbevredigend. Daarom wilden we een nieuw model bouwen.”
Rijke dataset
Anders dan ELN 2022, die gebaseerd is op consensus van verschillende studies, ging Versluis uit van een grote dataset van in totaal 1.910 intensief behandelde patiënten met AML ouder dan 60 jaar uit een Brits en een Nederlands-Belgisch-Zwitsers cohort (NCRI-AML18 en HOVON-SAKK).1 Versluis: “Dat was een heel rijke dataset met uitgebreide klinische, cytogenetische en mutatie-analyse. Het gaat om patiënten die in studies behandeld werden tussen 2007 en 2018 met intensieve chemotherapie. Alle patiënten waren geanalyseerd met een next-generation sequencing-panel van ongeveer 45 genen.”
De onderliggende biologie was bij deze patiënten anders dan bij jongere patiënten, zag hij. “Dit zijn meer leukemieën die zijn gerelateerd aan myelodysplastisch syndroom (MDS), die in de regel minder goed reageren op chemotherapie en een hoger risico geven op een recidief. 65% van de patiënten had MDS-gerelateerde afwijkingen, meer dan we van tevoren gedacht hadden.”
Vier groepen onderscheiden
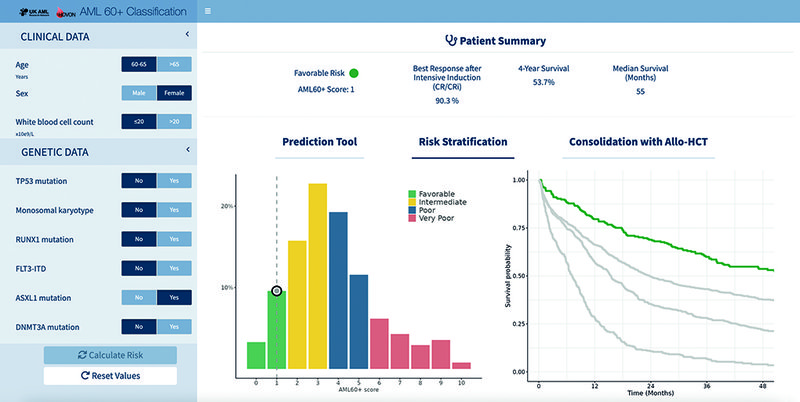
Versluis ontwikkelde het model eerst in een cohort van 1.204 patiënten met AML die waren behandeld tussen 2007 en 2016. Vervolgens werd het gevalideerd in een cohort van patiënten met AML die waren behandeld tussen 2017 en 2018 (n=491), en in een cohort van patiënten met hoogrisico (HR)-MDS die als AML behandeld waren (n=215). “In het ontwikkelingscohort selecteerden we de belangrijkste variabelen, negen in totaal. Op basis van de hazard ratios in een regressiemodel hebben we punten toegekend aan elk van die variabelen.” De belangrijkste factoren die een hoog risico geven zijn mutatie van TP53, monosomaal karyotype en leeftijd ouder dan 65 jaar. Andere factoren zijn bekende mutaties zoals in RUNX1, ASXL1 en DNMT3A. “Het zijn allemaal mutaties die in kleinere moleculaire panels relatief makkelijk te bepalen zijn”, aldus Versluis.
Het model verdeelt de patiënten op basis van de punten in vier groepen: favorable, intermediate, poor en very poor. “Die vier groepen hebben we vervolgens gevalideerd in de andere twee cohorten. Ook in de validatiecohorten kon het model heel goed vier groepen onderscheiden met een goede tot een heel slechte prognose.” De C-index was 0,694 in het ontwikkelingscohort, 0,666 in het AML-validatiecohort en 0,738 in het HR-MDS-cohort.
“Patiënten uit de ELN 2022 adverse risk-groep kwamen in de nieuwe classificatie verdeeld over de vier groepen terecht (zie Figuur 1). Binnen die heel grote ELN 2022 adverse risk-groep zie je dat het model nog steeds patiënten kan herkennen met betere en slechtere uitkomsten. Je vindt een groep die het relatief goed doet, met een vierjaars algehele overleving (OS) van bijna 50%, een intermediate risk-groep, maar ook een groep met een vierjaars-OS van slechts 3%.”
Niet altijd voordeel allo-HCT
Allo-HCT vormt de meest effectieve, curatieve behandeling voor deze patiënten, maar gaat gepaard met toxiciteit. “Patiënten met een minder hoog risico op een recidief, zoals de favorable risk-groep, hebben daardoor in relatieve zin geen baat bij een allo-HCT. In het algemeen hadden we de neiging deze oudere patiënten wel te transplanteren, vanwege de onderliggende biologie met meer hoogrisicokenmerken.”
In de retrospectieve dataset was te zien dat patiënten die een allo-HCT hadden ondergaan in alle vier de risicogroepen betere uitkomsten hadden. “Maar in de favorable risk-groep was dat verschil niet significant. Deze groep had ook heel goede uitkomsten zonder allo-HCT. In die groep zou je allo-HCT kunnen bewaren voor later, als de patiënt een recidief krijgt.”
In de andere drie groepen was allo-HCT geassocieerd met een betere overleving, zij het net niet significant in de poor risk-groep. “Hoewel de overleving na een allo-HCT niet spectaculair veel beter was, viel de sterke reductie van het aantal recidieven na allo-HCT op, ook in de favorable risk-groep. Maar dit werd aan de andere kant ingehaald door de non-recidiefmortaliteit. Netto is er dan een voordeel in met name de groepen met een intermediate en poor risk, en ook enigszins in de groep met een very poor risk, al is de (vroege) recidiefkans daar zo hoog dat de risicoreductie door allo-HCT minder is. Je zou je kunnen afvragen of allo-HCT wel de juiste behandeling is voor de very poor risk-groep, met een OS van ongeveer 10%. Misschien is bij die mensen een experimentele behandeling te overwegen.”
Het geobserveerde voordeel van allo-HCT moet met enige voorzichtigheid worden geïnterpreteerd, omdat het gebaseerd is op retrospectieve data, aldus Versluis. “Ook bij gebruik van de nieuwe AML 60+-risicoclassificatie blijft de behandelkeuze een individuele overweging. In het algemeen kun je zeggen dat allo-HCT voordeel biedt, maar let op de non-recidiefmortaliteit. Je moet van tevoren inschatten of die niet te hoog is.”
Online hulpmiddel
Op basis van de negen variabelen en de daarbij behorende punten kan de individuele score berekend worden die aangeeft in welke risicogroep een patiënt valt. Om dit nog eenvoudiger te maken, is een online hulpmiddel ontwikkeld.2 Daarin kan van elke variabele aangevinkt worden of deze bij de patiënt aanwezig is of niet. “De app geeft dan aan in welke risicogroep de patiënt valt en wat in onze data de respons was op intensieve chemotherapie. Ook kun je zien wat in deze groep de impact was van allo-HCT. Het laat zien wat er in onze data met deze patiënten is gebeurd, en kan informeren over de behandelkeuze.”
Blijven valideren
Voor mensen ouder dan 60 jaar werkt het nieuwe model beter dan ELN 2022, denkt Versluis. “Je krijgt nu een betere re-stratificatie van patiënten.” Een model als AML 60+ is echter geen statisch gegeven, benadrukt hij. “Sinds 2018 zijn er nieuwe middelen op de markt gekomen, waaronder midostaurine voor patiënten met een FLT3-mutatie. In de dataset die wij hebben gebruikt zijn patiënten nauwelijks behandeld met een FLT3-remmer, dus waarschijnlijk is de impact van bijvoorbeeld een FLT3-mutatie op het model anders als je deze analyse zou doen in de huidige tijd, waarin wel FLT3-remmers worden gegeven. Je moet dit soort modellen dus blijven valideren. Voor de oudere patiënten gaan we steeds meer toe naar niet-intensieve behandelingen. Het doel is om zoveel mogelijk patiënten in aanmerking te laten komen voor een allo-HCT, dat lukt misschien beter met bijvoorbeeld een combinatie van venetoclax en azacitidine. Dus we zullen AML 60+ ook nog in zo’n cohort moeten valideren.”
Referenties
1. Versluis J, et al. J Clin Oncol 2024:JCO2302631. Online ahead of print.
2. UK AML HOVON AML 60+ Classification. Te raadplegen via hovon-aml.shinyapps.io/AML60_score/
Dr. Astrid Danen, wetenschapsjournalist
Oncologie Up-to-date 2024 vol 15 nummer 6